
Entalpía de soluciones
Termodinámica
Muchas disciplinas científicas evolucionaron a partir de lo que alguna vez fueron consideraciones prácticas. La botánica, el estudio de las plantas, comenzó cuando las primeras personas buscaron plantas para usarlas como alimento y medicina.
La termoquímica , por otro lado, nació de la guerra. La termoquímica es más o menos lo que parece: el estudio de la relación entre las reacciones químicas y los cambios de energía relacionados con el calor. Los primeros estudios de termoquímica se utilizaron principalmente para fabricar cañones. Como seguramente puede imaginar, nadie quiere disparar un cañón a menos que esté bastante seguro de cómo ocurrirán estos cambios de calor y energía.
Según la Primera Ley de la Termodinámica, la energía no se puede crear ni destruir. Sin embargo, la energía puede cambiar de forma. El sol no genera energía cuando arde. El sol simplemente convierte la energía almacenada en átomos de hidrógeno en energía luminosa y térmica. Cuando disparas un cañón, estás tomando energía química almacenada en la pólvora y convirtiéndola en otras formas de energía: los gases en expansión, la luz del destello y la energía cinética de la bala de cañón.
 |
Entalpía
La entalpía es el calor transferido durante un proceso de presión constante. Proviene de las raíces griegas en , que significa poner en , y thalpein , que significa calentar . Entonces, literalmente, entalpía significa poner calor en algo.
La fórmula de la entalpía es:
H = E + PV
La H significa entalpía. La E significa energía interna, que se puede considerar como capacidad calorífica o energía térmica. El PV es presión multiplicada por volumen.
Pero en general, a la química no le gustan los absolutos. La química se preocupa más por cómo cambian las cosas. Normalmente representamos el cambio como la letra griega Delta, que parece un triángulo. Entonces nuestra ecuación sería:
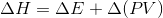 |
Entalpía de soluciones
La entalpía de las soluciones se refiere a la cantidad total de calor absorbido o liberado cuando dos sustancias se disuelven. Este total puede ser positivo o negativo. Una entalpía positiva de la solución da como resultado una reacción endotérmica , que absorbe calor y se siente fría al tacto. Una entalpía negativa de la solución da como resultado una reacción exotérmica , que emite calor y se siente caliente al tacto.
¿Por qué simplemente disolver una sustancia requeriría que absorba o desprenda calor? Deben tener lugar tres procesos separados, y si su cambio de entalpía no es exactamente igual a cero, habrá alguna pérdida o ganancia de calor.
El primer proceso que debe tener lugar es que el soluto , la sustancia que se está disolviendo, debe separarse. Quizás tenga un poco de sal de mesa, NaCl. El NaCl es una molécula porque el ión de sodio positivo es atraído por el ión de cloruro negativo, por lo que se mantienen unidos. Entonces, para disolver el NaCl, deberá ejercer una cierta cantidad de energía. Llamamos a la entalpía de este proceso:
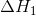 |
El segundo proceso que debe llevarse a cabo es que las moléculas en el solvente , la sustancia que se está disolviendo, deben separarse. Tal vez desee disolver la sal de mesa en agua. Las moléculas de agua son polares, por lo que sus polos parcialmente negativos se adhieren a los polos parcialmente positivos de las moléculas de agua vecinas. Se necesita algo de energía para separarlos. Llamamos a la entalpía de este proceso:
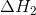 |
El tercer proceso que debe tener lugar es que el soluto y el solvente deben mezclarse. Llamamos a la entalpía de este proceso:
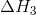 |
La ecuación para la suma de estos procesos es:
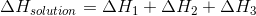 |
Hagamos un problema de muestra.
Si
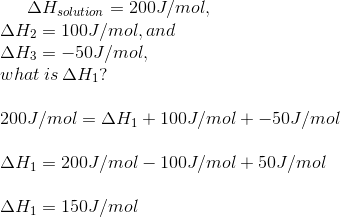 |
¡Apuesto a que fue más fácil de lo que esperabas!
Solo hay un caso especial más que debe conocer. Si la entalpía de la solución en una ecuación es exactamente cero, esa solución se denomina ideal .
Resumen de la lección
La termoquímica es la relación entre las reacciones químicas y los cambios de calor. Inicialmente se desarrolló para comprender mejor cómo funcionan los cañones. La energía nunca se crea ni se destruye, pero puede cambiar de forma. Por ejemplo, la energía química se puede convertir en energía térmica.
La entalpía es el calor transferido en un proceso de presión constante. La fórmula para el cambio de entalpía es:
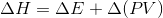 |
H representa entalpía, E representa energía interna y PV es presión multiplicada por volumen. Los deltas, o símbolos triangulares, representan los cambios en cada uno de estos componentes.
Cuando hablamos de la entalpía de las soluciones, estamos hablando del cambio de calor que se produce cuando dos sustancias se disuelven. Una reacción endotérmica absorbe calor y se siente frío, mientras que una reacción exotérmica libera calor y se siente caliente.
Una cierta cantidad de energía se absorbe o libera cuando el soluto , o la sustancia que se disuelve, se separa en sus partes componentes. Una cierta cantidad de energía se absorbe o libera cuando el disolvente , o la sustancia que se disuelve, se separa en las moléculas que lo componen. Finalmente, una cierta cantidad de energía se absorbe o libera cuando estas sustancias se mezclan. Si sumamos estos tres números, nuestra suma será la entalpía de la solución. Si la entalpía de la solución es cero, la solución es ideal .
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Isómeros haloalcanos: definición, nombres y estructura
- Funciones compuestas y funciones gráficas de funciones
- Me pregunto las ideas del proyecto
- Cómo se diferencian los sólidos cristalinos y los sólidos amorfos
- Unidades habituales de EE. UU. Para medir la capacidad
- Fertilizantes NPK: Definición y usos
- Similitudes entre sistemas en matemáticas, ciencia y tecnología
- Actividades de reflexión de la luz para estudiantes
- Proceso de sinterización: tipos, ventajas y desventajas
- Estructuras de puntos de Lewis: Iones poliatómicos
- Diferencia entre poblaciones y muestras en estadística
- Cómo reconocer declaraciones que fortalecen o debilitan argumentos
- Precipitación: Tipos y formación
- Hassium: Usos, hechos y propiedades
- Lantanoides y actinoides: configuración y comparación
