
Teoría del enlace de valencia: definición y ejemplos
La mecánica cuántica cambia la forma en que vemos las moléculas
En los días previos a la mecánica cuántica (que es una rama de la física que describe matemáticamente la interacción y el movimiento de las partículas subatómicas y los átomos), nuestra explicación de los enlaces y las formas de las moléculas covalentes se basaba principalmente en la teoría de la repulsión electrónica de la capa de valencia (VSEPR) que se basa en la premisa de que los pares de electrones, ya sean pares de enlace o no, se orientan en el espacio para estar lo más lejos posible de otros pares de electrones en una molécula. Pero esta teoría y las anteriores, aunque son buenos puntos de partida, no pueden explicar adecuadamente el enlace covalente y las geometrías moleculares que vemos en las moléculas. El modelado matemático en mecánica cuántica de orbitales atómicos nos ha proporcionado una buena representación visual de las formas de estos orbitales atómicos.
 |
La ilustración de arriba muestra las formas matemáticas de los orbitales atómicos (orbitales en la parte superior y el número de período (número cuántico principal) en el lado derecho, lo que nos ayuda a visualizar cómo los orbitales podrían interactuar para formar enlaces. Estos orbitales tienen orientaciones específicas y Los ángulos entre ellos en los átomos que influyen en los ángulos de enlace resultantes en una molécula. La aplicación de la mecánica cuántica a esta idea de enlace covalente ha llevado a dos teorías, siendo la teoría del enlace de valencia (VB) una de ellas, cada una con ventajas y desventajas sobre las teorías anteriores para explicar lo que se ve en las moléculas de la vida real.
La teoría VB considera el enlace covalente como una superposición de orbitales atómicos en lugar de simplemente un intercambio de electrones como en teorías anteriores. Un enlace covalente en la teoría de VB es un enlace formado cuando los orbitales atómicos de dos átomos se superponen y cada uno comparte un electrón con espines opuestos (puede recordar el número cuántico de espín del electrón, m s ) en la región de superposición entre los átomos. Esta región de superposición es una región de alta densidad de electrones que sirve para mantener unidos los átomos.
La razón por la que esta superposición crea un enlace entre los átomos es que hay una reducción en la energía potencial general de la molécula en comparación con las energías potenciales combinadas de los átomos por separado. Recuerde que la naturaleza trata de minimizar la energía, particularmente la energía potencial, de átomos, moléculas y partículas, por lo que si puede ocurrir algo que reduzca la energía total, se considera una situación deseable. Echemos un vistazo a la molécula covalente más simple, la molécula de hidrógeno diatómico, H 2 .
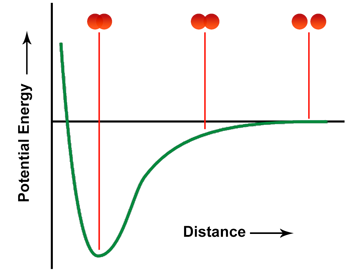 |
Vemos en la ilustración anterior una gráfica relativa de energía potencial versus la distancia entre dos átomos de hidrógeno. En el extremo derecho, los átomos de hidrógeno están separados entre sí, como un espacio entre las dos esferas. La energía potencial nominal de los átomos separados está al nivel del eje x. A medida que los átomos comienzan a superponerse (imagen central), hay una reducción en la energía potencial (PE) en relación con los átomos separados. Esta reducción de PE continúa a medida que los átomos se superponen más hasta que alcanza un mínimo (imagen de la izquierda).
Aquí es donde consideramos el enlace que se está formando y la distancia entre los átomos como la longitud de enlace asociada de ese enlace covalente. Si tuviéramos que aumentar más la superposición de los orbitales atómicos, el PE aumenta bruscamente, lo que sugiere que otras interacciones entran en juego aumentando el PE general. La distancia óptima entre los dos átomos, la longitud del enlace, para el enlace HH es 74 pm (picómetros). Por lo tanto, los átomos solo pueden acercarse un poco antes de que comiencen a surgir problemas, pero deben estar lo suficientemente cerca para minimizar la energía potencial de la molécula.
Un ejemplo con agua
Ahora considere una molécula más compleja como el agua. Cada átomo de hidrógeno tiene una configuración electrónica de capa de valencia de 1 s 1. La configuración electrónica de capa de valencia del oxígeno es 2 s 2, 2 p x 2, 2 p y 1, 2 p z 1. Así que tenemos dos posiciones de electrones vacantes en el oxígeno que potencialmente puede formar enlaces con dos átomos de hidrógeno siempre que los electrones en el oxígeno y el hidrógeno tengan espines opuestos.
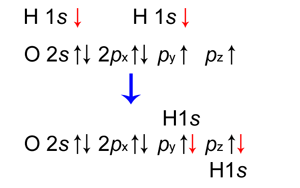 |
La ilustración muestra cómo los espines deben ser opuestos para que los orbitales atómicos del hidrógeno 1 s se superpongan con los orbitales atómicos del oxígeno 2 p para formar enlaces. La distancia / superposición óptima entre los átomos aquí que da un mínimo de PE para un enlace OH es 96 pm, diferente a la de un enlace HH.
Factores a considerar con moléculas complejas
Aquí hay algunos factores importantes que surgen de nuestra consideración de una molécula más compleja:
- La mayoría de los electrones de una molécula permanecen en sus orbitales atómicos originales. Solo los orbitales parcialmente llenos involucrados en la formación real del enlace se ven afectados.
- Los electrones de enlace de dos átomos se localizan en la región entre los dos átomos de enlace. Esto significa que matemáticamente hay una mayor probabilidad de encontrar los electrones en el espacio de superposición que en el resto del orbital atómico de cada átomo.
- Para los orbitales atómicos con lóbulos direccionales, es decir , orbitales p , d y f , se produce una superposición máxima más estable entre los orbitales cuando se superponen de un extremo a otro a lo largo de sus ejes centrales. Esto significa que estos enlaces son direccionales y están sujetos a la orientación de los orbitales atómicos alrededor del átomo central.
- La geometría molecular y los ángulos de enlace están sujetos a los de los orbitales atómicos del átomo central. Para el agua, el ángulo de enlace entre los orbitales atómicos 2 p en el oxígeno es de 90 °. La teoría VSEPR predice un ángulo de enlace de 109,5 °. El ángulo de enlace determinado experimentalmente está más cerca de 104,5 °, por lo que parece que la teoría VB tiene un ángulo de enlace más cercano a los orbitales atómicos y es un mejor predictor de los ángulos de enlace molecular de los átomos centrales que las teorías anteriores.
Resumen de la lección
La teoría del enlace de valencia ha surgido de la aplicación de la mecánica cuántica para describir matemáticamente la interacción de los átomos para formar enlaces covalentes. La formación de enlaces covalentes en la teoría de enlaces de valencia implica la superposición de orbitales atómicos que tienen electrones individuales con espines opuestos . La superposición de los orbitales atómicos individuales de los dos átomos crea un área de alta densidad de electrones en la región de superposición que corresponde a una mayor probabilidad de encontrar los electrones en esta región que en el resto de los orbitales atómicos. Los enlaces covalentes formados tendrán una longitud de enlace característica. que es donde la energía potencial del enlace es mínima en comparación con la energía potencial combinada de los átomos por separado.
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Datos del elemento flúor: lección para niños
- Actividades de reflexión de la luz para estudiantes
- Tipos de cerámica: usos y propiedades
- Nomenclatura y notación química
- Cómo utilizar el equipo y los materiales del laboratorio de ciencias »Wiki Ùtil
- ¿Qué es el Muestreo de Datos?
- Creación de mezclas mediante la combinación de elementos y compuestos
- ¿Qué es el cobre? – Usos, propiedades y síntomas de deficiencia
- Resolver ecuaciones lineales: problemas de práctica
- ¿Qué es un amperímetro? – Definición y función
- Reacciones de los ácidos: metales, carbonatos e hidróxidos
- Hidróxido de amonio: Fórmula y usos
- ¿Qué es disprosio? – Descubrimiento y propiedades
- Embriogénesis humana: definición y etapas
- Yodo: síntomas de deficiencia y toxicidad
