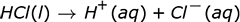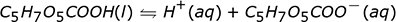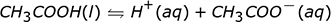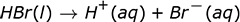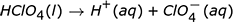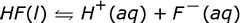Ácidos Comunes: Fortalezas y Ionización
Clasificación de la fuerza del ácido
Si alguien le dijera que tiene un recipiente de ácido que puede atravesar el vidrio, disolver rocas y quemar su piel, ¡probablemente pensaría que es un ácido fuerte! Sin embargo, resulta que el ácido fluorhídrico, HF, puede hacer todo esto y, sin embargo, un químico le diría que es un ácido débil. Esto se debe a que los químicos clasifican la fuerza del ácido no por la corrosividad del ácido, sino por la cantidad de ionización que se produce cuando el ácido se coloca en agua.
Reacciones de ionización
La ionización es el proceso por el cual una molécula se rompe en dos tipos de iones. Uno es un catión cargado positivamente y el otro un anión cargado negativamente.
Cuando un ácido se ioniza en agua, el catión es siempre el ion hidrógeno, H + . Este ion de hidrógeno se adhiere rápidamente a una molécula de H 2 O para convertirse en H 3 O + o el ion hidronio. Es por eso que en muchos textos verá H + y H 3 O + referenciados indistintamente.
El anión en la ionización ácida es el ión negativo que queda después de que el H + abandona la molécula. A continuación se muestran algunos ejemplos de reacciones de ionización para algunos ácidos comunes en el agua. Tenga en cuenta que en estas reacciones la letra entre paréntesis que sigue al compuesto indica el estado de la materia de ese compuesto, donde l es líquido y aq es acuoso.
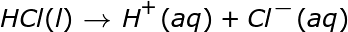 |
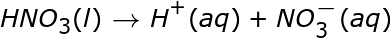 |
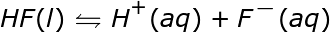 |
Uso de reacciones de ionización para clasificar ácidos fuertes frente a débiles
Observe que dos de las reacciones escritas arriba tienen flechas que apuntan solo a la derecha, mientras que una tiene flechas dobles que apuntan en ambas direcciones. Esto se debe a que no todos los ácidos se ionizan por igual. Las reacciones con solo flechas apuntando hacia la derecha muestran que estas reacciones proceden completamente. Cada molécula de ese ácido que se coloca en el agua se descompone en iones. Si pudiéramos examinar un vaso de precipitados de HNO 3 acuoso , ácido nítrico, a nivel molecular, no veríamos moléculas de HNO 3 . Solo veríamos iones H + e iones NO 3 – . Un ácido que se descompone completamente en iones, o se ioniza el 100% del tiempo, es un ácido fuerte .
La reacción que muestra flechas en ambos sentidos indica que este ácido no se disuelve por completo cuando se coloca en agua. Algunas de las moléculas de ácido permanecen juntas y no forman iones. Si pudiéramos examinar un vaso de precipitados de HF acuoso, ácido fluorhídrico, a nivel molecular veríamos algunos iones H + y algunos iones F – pero también veríamos algunas moléculas de HF todavía juntas en el agua. Esto es lo que queremos decir cuando decimos que el ácido no se ioniza completamente. Un ácido que no se ioniza el 100% del tiempo es un ácido débil y la cantidad de ácido no ionizado determina la debilidad relativa del ácido. Cuanto más ácido no ionizado, más débil es el ácido.
Cuantificación de la cantidad de ionización y concentraciones ácidas relativas
Veamos tres ácidos comunes diferentes y clasifíquelos según su fuerza según lo que sabemos sobre su ionización. Dada la misma cantidad de cada ácido, en esta tabla se ha calculado el porcentaje de ionización.
| Ácido | % De ionización | Reacción de ionización | |
|---|---|---|---|
| Ácido clorhídrico HCl |
100% |
|
|
| Ácido cítrico C 6 H 8 O 7 |
8,6% |
|
|
| Ácido acético CH 3 COOH |
1,3% |
|
Vemos que el HCl se ioniza el 100% del tiempo. También podemos ver esto en la forma en que se escribe la reacción. Observe que solo se incluye una flecha que apunta hacia los productos de ionización. Esto también significa que cada molécula se descompone en iones. Un ácido que se ioniza completamente es un ácido fuerte. Por tanto, el HCl es un ácido fuerte.
Tanto el ácido cítrico como el ácido acético son ácidos débiles. Podemos ver esto de dos formas. Ninguno de los ácidos se ioniza el 100% del tiempo, y ambas reacciones de ionización están escritas con flechas dobles. Sin embargo, no son igualmente débiles. El ácido acético es el más débil de los dos porque ioniza menos que el ácido cítrico. Esto nos dice que si tomamos una cantidad igual de cada una de estas moléculas y las colocamos en agua, la solución de HCl contendría la mayor cantidad de iones H + y la solución de ácido acético contendría la menor cantidad de iones H + .
Otros ácidos comunes
El porcentaje de ionización para soluciones 1,0 M de ácidos comunes, así como sus reacciones de ionización, se resumen en la siguiente tabla. Los ácidos fuertes se enumeran en la parte superior de la tabla y los ácidos restantes se enumeran en orden del más fuerte al más débil.
| Ácido | % De ionización | Reacción de ionización | |
|---|---|---|---|
| Ácido clorhídrico HCl |
100% |
|
|
| Ácido bromhídrico HBr |
100% |
|
|
| Ácido hidroyódico HI |
100% |
|
|
| Ácido nítrico HNO 3 |
100% |
|
|
| Ácido perclórico HClO 4 |
100% |
|
|
| Ácido cítrico C 6 H 8 O 7 |
8,6% |
|
|
| Ácido nitroso HNO 2 |
2,7% |
|
|
| Ácido fluorhídrico HF |
2,6% |
|
|
| Ácido acético CH 3 COOH |
1,3% |
|
|
| Ácido hipocloroso HClO |
0,017% |
|
Nota: Para calcular el porcentaje de ionización de los ácidos débiles en esta lección, se utilizó un cálculo que utiliza un valor llamado Ka, la constante de ionización del ácido, junto con la concentración del ácido.
Resumen de la lección
La fuerza del ácido está determinada por la cantidad de ionización que se produce cuando se coloca un ácido en una solución acuosa. Los ácidos fuertes ionizan el 100% del tiempo. Los ácidos débiles se ionizan menos del 100% del tiempo. La debilidad relativa del ácido está determinada por la cantidad de ionización que se produce. Cuanto menos ionización, más débil es el ácido.
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Inmunidad colectiva: definición y umbral
- Contracción de actínidos: definición y causas
- El coeficiente de correlación: definición, fórmula y ejemplo
- Lección de mezclas y plan de soluciones para la escuela primaria
- Uso de pruebas de llama para identificar iones metálicos
- Reacciones intramoleculares de cicloadición de Diels-Alder
- Función algebraica: definición y ejemplos
- Azul de bromotimol: definición, usos y fórmula
- Nombrar alcoholes con la nomenclatura IUPAC
- Preparación y usos del cianato de plata
- ¿Qué es la química verde? – Lección para niños
- Grupos funcionales en moléculas orgánicas: Resumen, lista y ejemplos
- Tipos y equipos de automatización de laboratorio
- ¿Qué es la toxicocinética? – Definición y principios
- Propiedad de identidad: definición y ejemplos