
Grupo Carbonilo: Propiedades y descripción general
¿Qué es un grupo carbonilo?
En química orgánica, un grupo carbonilo es un grupo funcional donde un átomo de carbono está doblemente unido a un átomo de oxígeno. Una excelente manera de recordar que se trata de carbonilo es mirar la palabra en sí. ‘Carb’ le recuerda que se necesita un átomo de carbono, mientras que ‘O’ representa el átomo de oxígeno. Ahora que sabemos cómo se ve el carbonilo, aprendamos más sobre sus propiedades.
Propiedades del carbonilo
El grupo carbonilo se encuentra en muchos otros grupos funcionales, desde aldehídos y anhídridos hasta cetonas y ácidos carboxílicos, solo por nombrar algunos. El punto clave para recordar es que siempre que vea la fórmula doble enlace carbono-oxígeno (C = O), sabrá que hay un carbonilo presente en ese grupo funcional.
Otra característica del grupo carbonilo es su polaridad. Una sustancia polar es un compuesto que lleva cargas parciales positivas y negativas. La polaridad del carbonilo influye en dos cosas sobre la propiedad de un compuesto: aumenta los puntos de fusión y ebullición e influye en la solubilidad del compuesto. Abordemos cómo se relaciona la polaridad con cada uno de estos.
Primero, ¿cómo se relaciona la polaridad con los puntos de fusión y ebullición? Los compuestos polares utilizan fuerzas muy fuertes para mantener fuertes los enlaces entre cada átomo del compuesto. Como puede sospechar, es difícil romper estos lazos. Si coloca un compuesto polar en una olla y aumenta la temperatura, la cantidad de energía necesaria para romper los enlaces influye en el punto de ebullición. El mismo principio se aplica al punto de fusión. Pero tenga en cuenta que otros factores, como el tamaño del compuesto, también pueden afectar los puntos de ebullición y fusión.
En cuanto a la polaridad y la solubilidad, están relacionadas debido al concepto muy simple de que lo similar se disuelve. El agua es polar y el carbonilo es polar, por lo que el agua disuelve el carbonilo. Ahora que entendemos las propiedades del carbonilo, centrémonos en su estructura.
Importancia de la resonancia de Carbonyl
Mira estas dos estructuras:
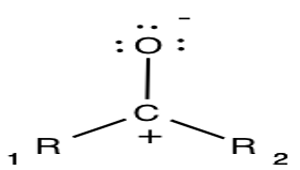 |
¿Notas algo diferente en un grupo carbonilo? Esa diferencia es la ausencia del doble enlace. El carbonilo puede transformarse en diferentes estructuras, utilizando los mismos átomos, carbono y oxígeno. En química, esto se llama estructura de resonancia. Las estructuras de resonancia se dibujan de una manera especial para ayudarnos a comprender por qué la molécula tiene una carga positiva y negativa. Aquí vemos cómo escribir una estructura resonante para carbonilo:
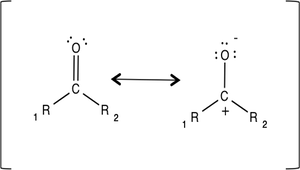 |
Cuando dibuje estas estructuras, no olvide la flecha de doble cara y los corchetes. Estos le permiten a las personas saber que el carbonilo puede cambiar las estructuras.
Es posible que haya notado que el átomo de oxígeno tiene puntos flotando a su alrededor con un signo de carga negativa en la parte superior. Esos puntos representan pares de electrones solitarios, lo que hace que el átomo de oxígeno sea electronegativo. El par solitario se refiere a dos electrones que pueden vivir solos sin necesidad de unirse a un átomo. En pocas palabras, los pares de electrones solitarios son tipos duros independientes.
Los átomos electronegativos tienen hambre de electrones y les encanta atraer a otros átomos. Harán lo que sea necesario para obtener electrones de otro átomo. Entonces, ¿cómo se relaciona esto con un par de electrones solitarios? Recuerde que a los átomos electronegativos les encanta tomar electrones. Por lo tanto, un solo par de electrones es la comida perfecta para los átomos electronegativos. Se extenderán y agarrarán a esos pares solitarios, acercándolos a ellos y al átomo al que están destinados. Esto explica por qué el átomo de oxígeno tiene un signo de carga negativa. Tomó tantos electrones del átomo de carbono que tiene más de los que necesita.
Lo que nos lleva al carbono. Es posible que haya notado que el átomo de carbono no tiene un solo par de electrones flotando alrededor, y tiene un signo de carga positivo. Puede pensar en el átomo de carbono como una persona agradable que está dispuesta a donar sus electrones para mantener felices a todos. A esto se le llama nucleófilo.
¿Por qué Double Bond a Carbonyl?
No podríamos terminar esta lección sin mencionar el doble enlace en un grupo carbonilo. Aunque pueda parecer que el doble enlace no está haciendo mucho, en realidad juega un papel en dos áreas importantes: polaridad y reactividad. Si saca su regla y mide la longitud del doble enlace en un grupo carbonilo para cada químico, obtendrá diferentes longitudes. La longitud del doble enlace influye en la polaridad. Cuanto más largo sea el enlace, más polar puede ser una sustancia.
Con reactividad, al doble enlace en el grupo carbonilo le encanta ser incluido en el bombo y participar en reacciones químicas. La voluntad de romper sus lazos y mezclarse con otros químicos hace que el carbonilo sea un amigo reactivo con el que pasar el rato.
Resumen de la lección
Los grupos carbonilo contienen un átomo de carbono con doble enlace a un átomo de oxígeno. Se pueden encontrar en varios grupos funcionales diferentes, como aldehídos, cetonas, ésteres y muchos más. Un grupo carbonilo puede aumentar el punto de fusión o ebullición de un compuesto. Se describe como polar y reactivo, y las cargas negativas y positivas de un carbonilo contribuyen a la polaridad.
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Bromuro de sodio: Compuesto y fórmula
- Cómo dibujar diagramas de monómeros »Wiki Ùtil
- Compuestos iónicos: formación, energía de celosía y propiedades
- Electrólisis de soluciones acuosas
- Equipo de seguridad de laboratorio estándar
- Sistema de clasificación de sustancias de Thomas Graham
- Funciones hiperbólicas inversas: propiedades y aplicaciones
- Estímulos y estrés ambientales: Adaptaciones y respuestas de las plantas
- Efectos de la piperazina en humanos, gatos y perros »Wiki Ùtil
- Éter: preparación y reacciones
- Lección de derecho científico para niños: definición y ejemplos
- Carl Bosch: biografía, hechos e invenciones
- Yodo de aluminio: fórmula, ecuación y reacción
- Reglas de prioridad de Cahn-Ingold-Prelog en química
- Sacar conclusiones de encuestas de muestra
