
¿Qué es el tiosulfato de sodio? – Fórmula y propiedades
Tiosulfato de sodio
Uno de los venenos más letales que conoce la humanidad es el cianuro. La intoxicación por cianuro puede provocar un ritmo cardíaco acelerado y una respiración acelerada. Una persona puede tener una convulsión, perder el conocimiento y eventualmente morir como resultado.
Sin embargo, existen tratamientos para las personas que pueden llegar a un hospital lo suficientemente rápido. Uno de estos tratamientos implica un medicamento químico conocido como tiosulfato de sodio . Esta lección describe su fórmula y propiedades.
Fórmula
El tiosulfato de sodio tiene una fórmula molecular de Na 2 O 3 S 2 . Aquí, el Na representa sodio, la O representa oxígeno y la S representa azufre. Probablemente pueda encontrar el sodio y el sulfato en el nombre, tiosulfato de sodio. El oxígeno también es parte del sulfato, ya que un sulfato es un átomo de azufre unido a átomos de oxígeno.
Propiedades
A temperatura ambiente, el tiosulfato de sodio se encuentra en forma de cristal en polvo o incoloro. Estos son algunos datos básicos sobre este compuesto:
- peso molecular = 158.097 g / mol
- masa exacta = 157,908 g / mol
- punto de fusión = 48,5 grados Celsius (119,3 grados Fahrenheit)
- densidad = 1,7 g / cm 3
Cuando se calienta, el tiosulfato de sodio puede producir humos muy tóxicos de óxido de disodio y óxidos de azufre. El tiosulfato de sodio también puede donar sus átomos de azufre, si es necesario.
Y esa última propiedad es clave para relacionarnos con nuestra introducción, ya que probablemente lo que más le interese es saber cómo se puede usar este químico en medicina para salvar la vida de una víctima de envenenamiento por cianuro.
Conversión de cianuro
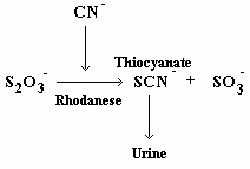
Lo crea o no, su cuerpo tiene un sistema para desintoxicarse del cianuro. Este sistema depende de una enzima llamada rodanesa , que convierte el cianuro (CN-) en tiocianato (SCN-). El tiocianato es básicamente la versión menos tóxica del cianuro.
Por supuesto, si una persona toma demasiado cianuro, este sistema que salva vidas se sobrecarga y el rodaneso no puede transformar el cianuro en tiocianato lo suficientemente rápido como para salvarle la vida.
¡Tiosulfato de sodio al rescate! Puede pensar en el tiosulfato de sodio como una organización benéfica. En lugar de regalar comida o ropa, dona sus átomos de azufre. Al regalar un átomo de azufre (S), permite que la rodanesa transforme el cianuro en tiocianato más rápidamente. Recuerde, CN- se convierte en SCN-. Tenga en cuenta el átomo de azufre en el tiocianato (SCN-), que hace que el cianuro original sea mucho menos dañino.
En esta reacción, la enzima rodanesa ayuda a separar un átomo de azufre del tiosulfato de sodio. En Na 2 O 3 S 2 . hay dos átomos de azufre, por lo que el rodaneso puede cortar uno. Esto forma una molécula de azufre de rodanesa. Esta molécula reacciona fácilmente con el cianuro. La molécula transfiere el azufre al cianuro para formar tiocianato.
El tiocianato puede luego excretarse del cuerpo a través de la orina. De hecho, el tiosulfato de sodio puede acelerar la conversión de cianuro en tiocianato en más de 30 veces. Todo gracias a su propiedad de poder donar un átomo de azufre.
 |
Resumen de la lección
El tiosulfato de sodio tiene una fórmula de Na 2 O 3 S 2 .
Entre sus propiedades destacan:
- Un punto de fusión es de 48,5 grados Celsius, que es de unos 119,3 grados Fahrenheit.
- Un peso molecular de 158,097 g / mol.
- Una densidad de 1,7 g / cm 3 .
También tiene la capacidad de donar un átomo de azufre para ayudar a transformar el cianuro en tiocianato a través de la enzima rodanesa .
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Interpretación de relaciones lineales usando datos: Problemas de práctica
- ¿Qué es un recíproco? – Definición y ejemplos
- Pigmentos: definición, tipos y efectos
- La reacción de Wittig y la síntesis de alquenos: definición y ejemplos
- Sustitución aromática nucleofílica
- Compuestos de aluminio: propiedades y uso de plantas
- Determinación de la estructura de proteínas y espectroscopía de RMN
- Sir Isaac Newton y la astronomía
- ¿Qué es el dióxido de azufre? – Definición, fórmula y usos
- Ley de Dalton: cálculo de presiones parciales y totales
- Similitudes entre sistemas en matemáticas, ciencia y tecnología
- ¿Qué es Aldolasa? – Definición, mecanismo y reacción
- Hechos de Antoine Lavoisier: lección para niños
- Oxalato: definición, alimentos y fórmula
- ¿Qué es el Meitnerio? – Usos, hechos y propiedades
