
Estructura del octano: fórmula y masa molar
¿Qué es el octano?
Mucha gente ha escuchado el término “octano”, tal vez en el contexto de los automóviles y la gasolina, pero algunos no están muy seguros de qué es el octano en un sentido técnico. La definición de octano es una molécula que tiene la fórmula química C8H18. El prefijo ”oct” indica el número de átomos de carbono en la molécula.
Como se desprende claramente de su fórmula química, el octano es un hidrocarburo (una molécula que consta únicamente de hidrógeno y carbono). Más específicamente, es un alcano, que es un hidrocarburo con solo enlaces simples. El sufijo ”-ano” indica el hecho de que el octano es un alcano.
El octanaje es un componente del combustible de motor estándar que se utiliza para las clasificaciones de gasolina. Un índice de octanaje superior a 100 indica un mejor rendimiento del motor que el octanaje, mientras que un índice inferior a 100 indica un peor rendimiento que el octanaje.
Fórmula de octano
Si bien cualquier forma de octano tiene la fórmula química C8H18 porque todas las formas de octano están formadas por ocho átomos de carbono y 18 átomos de hidrógeno, existen más de una docena de variedades de octano. Estas variedades, que se denominan isómeros, difieren en la geometría de cómo se conectan los átomos de carbono entre sí.
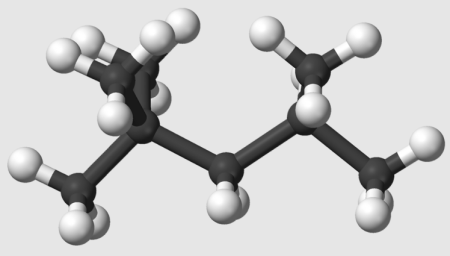
El isómero más básico del octano es lineal, también conocido como cadena lineal (consulte la Figura 1). Se llama n-octano para diferenciarlo de los isómeros ramificados. La fórmula estructural condensada del n-octano es CH3(CH_2)6CH3, lo que muestra que la molécula tiene dos grupos metilo terminales (CH3) conectados por seis átomos de carbono, cada uno de los cuales tiene dos átomos de hidrógeno unidos.
 |
Estructura de octano
Aparte del n-octano, todos los isómeros del octano están ramificados, lo que significa que al menos un átomo de carbono está conectado a más de otros dos átomos de carbono. Como resultado, la estructura de octano de estos isómeros tiene un esqueleto lineal que tiene menos de ocho carbonos de largo.
El octano tiene 18 isómeros estructurales (también llamados isómeros constitucionales). Estos 18 isómeros estructurales resultan de las diferentes formas de conectar ocho átomos de carbono entre sí usando solo enlaces simples. Solo la disposición de los átomos de carbono determina el isómero; una vez que los átomos de carbono están en su lugar, solo hay una forma de llenar los hidrógenos, dado que no hay enlaces dobles o triples en el octano.
El isómero 2,2,4-trimetilpentano es el isómero utilizado para los índices de octano. También se conoce como isooctano (ver Figura 2). La fórmula estructural condensada del isooctano es (CH3)3CCH2CH(CH3)2. El isooctano tiene un esqueleto de carbono de cinco carbonos (de ahí el “pentano” en su nombre), con dos grupos metilo saliendo del segundo de esos carbonos y un grupo metilo saliendo del cuarto carbono, como lo indica el ”2,2,4-trimetil” en su nombre.
 |
Propiedades de octano
El octano es útil debido a sus propiedades químicas. Las propiedades del octano incluyen:
- Punto de ebullición de octano: 125,6 ºC a la presión estándar de 1 atm. Por lo tanto, el octano tiene un punto de ebullición más alto que el agua.
- Punto de fusión de octano: -56,8 ºC a 1 atm. Por lo tanto, el octano tiene un punto de fusión más bajo que el agua.
- Masa molar octano: 114,23 g/mol. Esta es la suma de las masas molares de cada átomo en octano.
- Solubilidad en octano en agua: 0,66 mg por litro a 25 ºC. Por lo tanto, el octano es apenas soluble en agua. Es no polar, lo que significa que sus electrones se distribuyen uniformemente a través de la molécula. Por el contrario, el agua es polar. Las sustancias polares y no polares no se mezclan bien.
- Densidad de octano: 0,6986 g/mL a 25 ºC. Por lo tanto, el octano es menos denso que el agua.
- Calor de combustión de octano: 5470 kJ por mol a 1 atm y 20 ºC. Este gran valor hace que el octanaje sea un buen combustible, ya que libera mucha energía cuando se quema.
Usos de octano
El octano se utiliza en una variedad de contextos. Los usos del octano incluyen:
- Como se mencionó anteriormente, el octanaje se usa para las clasificaciones de gasolina. Por ejemplo, los tipos de gasolina 87, 89 y 93 que se venden comúnmente en las gasolineras tienen un 87, 89 y 93 por ciento, respectivamente, del rendimiento del motor de la mezcla estándar de octano/heptano. Además, los índices de octanaje más altos reflejan menos golpeteo del motor (causado por la detonación prematura de la mezcla de aire/combustible en el motor) y un mejor rendimiento del motor. En consecuencia, se utiliza como agente antidetonante para combustibles de alta compresión.
- El octano se usa como solvente para solutos no polares y como diluyente de laca.
- También se utiliza como agente de soplado para gomaespuma.
- Se utiliza en la destilación azeotrópica, que es un método de laboratorio para separar los componentes de una mezcla en función de las diferencias en las volatilidades de los componentes.
Resumen de la lección
El octano es un hidrocarburo (una molécula que consta únicamente de hidrógeno y carbono) con ocho átomos de carbono, como lo indica el prefijo “oct”. El sufijo ”-ano” indica que es un alcano, que es un hidrocarburo que tiene solo enlaces simples. El alto calor de combustión del octano lo convierte en un excelente combustible. De hecho, el octanaje es un componente del combustible estándar utilizado para las clasificaciones de octanaje de la gasolina. Los índices de octanaje más altos reflejan menos golpeteo del motor y un mejor rendimiento del motor. El octano también se usa como solvente, diluyente de laca, agente de soplado de caucho de espuma, agente de destilación azeotrópica y agente antidetonante para combustibles de alta compresión. El octano tiene un punto de ebullición más alto, un punto de fusión más bajo y una densidad más baja que el agua. Tiene una muy baja solubilidad en agua debido a su naturaleza no polar.
El octano tiene 18 isómeros estructurales (es decir, isómeros constitucionales), que son reordenamientos de una molécula. Todos los isómeros de octano tienen la fórmula química C8H18, pero tienen diferentes fórmulas estructurales condensadas. La fórmula estructural condensada del n-octano, la versión de cadena lineal del octano, es CH3(CH2)6CH3. El 2,2,4-trimetilpentano, también conocido como isooctano, es el isómero que está presente en el combustible estándar utilizado para los índices de octano. Tiene una fórmula estructural condensada de (CH3)3CCH2CH(CH3)2. El ”2,2,4-trimetilo” en el nombre del isómero muestra que hay dos grupos metilo unidos al segundo carbono en el esqueleto de la molécula y un grupo metilo unido al cuarto carbono.
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- ¿Qué son los polímeros? – Propiedades, aplicaciones y ejemplos
- Lección de escandio para niños: descubrimiento, propiedades y usos
- Fórmula y reacciones del metano
- Producción industrial de hidróxido de sodio: Procesos y ecuaciones
- Uso de propiedades termodinámicas para resolver problemas
- Ácido acrílico: usos, toxicidad y almacenamiento
- Hormonas gastrointestinales: definición, tipos y funciones
- Antoine Lavoisier: biografía, hechos y citas
- Funciones compuestas y funciones gráficas de funciones
- Acenaftileno: Usos y Aromaticidad
- ¿Qué es la hidrólisis de sal? – Definición y ejemplos
- Cómo encontrar la factorización prima de un número
- Definición de la diferencia entre parámetros y estadísticas
- ¿Qué es la desorción? – Definición y Proceso
- Monitoreo de fármacos terapéuticos: definición y técnicas
