
Constante de equilibrio y potencial de celda
Potencial de celda electroquímica
Las celdas galvánicas son celdas electroquímicas que contienen una reacción redox espontánea. Las reacciones redox son un tipo específico de reacción química en la que hay reactivos que pierden electrones, lo que se denomina oxidación, y reactivos que ganan esos electrones, lo que se denomina reducción.
Las celdas galvánicas se componen de dos semiceldas: el ánodo, donde se produce la oxidación, y el cátodo, donde se produce la reducción. Cuando estas celdas están conectadas, los electrones fluyen desde el cátodo al ánodo, creando energía eléctrica. Esta energía se puede describir como potencial de celda estándar.
Este potencial de celda estándar calcula el voltaje máximo creado al juntar esas dos medias celdas, que es cuando solo hay reactivos y no hay productos. Después de conectar dos semiceldas durante un tiempo, el voltaje medido es cero, porque la reacción ha alcanzado el equilibrio. El equilibrio de una reacción redox se puede resolver usando la ecuación de Nernst.
La ecuación de Nernst
La ecuación de Nernst generalmente establece:
 |
Donde E es el potencial estándar de la celda, R es la constante de los gases, T es la temperatura en Kelvin, n es el número de electrones que se mueven en la reacción redox, F es la constante de Faraday y Q es el cociente de reacción. El cociente de reacción es la concentración de productos sobre la concentración de reactivos, y en el equilibrio, Q = K, que es la constante de equilibrio.
Entonces, sumando las constantes y suponiendo que la reacción se mantiene a temperatura ambiente, o 298 K, la ecuación se puede reducir a:
 |
Ejemplos de cálculo de la ecuación de Nernst
Esta ecuación se puede usar para resolver la constante de equilibrio de una reacción si se conoce su potencial estándar, y viceversa.
Resolviendo para la constante de equilibrio
¿Cuál es la constante de equilibrio de la siguiente reacción redox?
 |
Para iniciar este problema, se debe encontrar el potencial estándar de la celda. Las tablas muestran el potencial de reducción de Ag +1 a Ag = 0,80. Tenga en cuenta que aunque la mitad de la ecuación que involucra a la plata se multiplica por dos para equilibrar los 2 electrones del zinc, el potencial no se multiplica por dos.
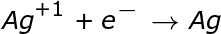 |
Zn +2 a Zn = -0,76. Dado que el zinc se oxida en esta reacción, la ecuación de media celda se invierte, por lo que el signo del potencial se invierte, dando 0,76.
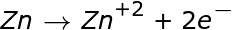 |
Estos números se suman para obtener un potencial de celda estándar de 1,56 (0,80 + 0,76 = 1,56) para la reacción. Este valor se puede conectar a la ecuación de Nernst simplificada. Además, dado que hay dos electrones moviéndose en esta reacción, n es 2.
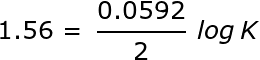 |
Luego se resuelve K, lo que conduce a
K= 5,04 x 10 52
Como K es muy grande, en el equilibrio quedan casi todos los productos y casi no quedan reactivos.
Resolviendo para el potencial de celda estándar
Una celda galvánica se configura con la siguiente reacción redox.
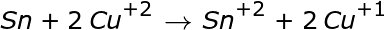 |
La constante de equilibrio de la reacción es 6.8 x 10 9 , ¿cuál es el potencial estándar de la celda?
Primero, la cantidad de electrones que se mueven en la reacción es 2, porque el estaño está perdiendo dos electrones, lo que reducirá dos iones de cobre. Una vez que se encuentra, los valores de n y K se pueden reemplazar en la ecuación de Nernst y E se puede resolver para
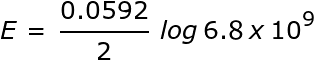 |
E = 0,291 V
El potencial estándar de la celda es de 0,291 voltios.
Resumen de la lección
La electroquímica gira en torno a una reacción química específica llamada reacción redox. Una reacción redox contiene un componente que pierde electrones, u oxidación , y un componente que gana esos electrones, o reducción . Cuando se establece una reacción redox en una celda galvánica, el flujo de electrones crea energía eléctrica que se mide en voltios. El potencial estándar de una celda es el voltaje producido cuando las celdas contienen todos los reactivos y ningún producto. Cuando la celda tiene un voltaje de cero, la reacción ha alcanzado el equilibrio.
Estos estados se pueden relacionar usando la ecuación de Nernst :
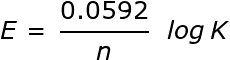 |
donde E es el potencial estándar de la celda, n es el número de electrones que se mueven en la reacción balanceada y K es la constante de equilibrio. Esta ecuación se puede usar para resolver la constante de equilibrio de una reacción si se conoce el potencial estándar, y viceversa.
Aprende más sobre:
Arte Arquitectura Biologia Ciencia Ciencia Fisica Ciencias de la Tierra Ciencias Sociales Economia Historia Historia Mundial Historia Moderna Medio Ambiente y Ecologia Literatura Plantas y Animales Religiones del Mundo QuimicaArticulos relacionados
- Problemas de práctica de física de caída libre
- Densidad y flotabilidad de objetos: Laboratorio de física
- Cómo realizar la suma: pasos y ejemplos
- Movimiento uniformemente acelerado y las cinco grandes ecuaciones cinemáticas
- Diferencias entre plasma y gas ideal
- El potencial de un cilindro
- ¿Qué es la Diferencia Potencial? Definición, cálculo y ejemplos
- Escribir y resolver problemas verbales de resta con una variable
- Distribuciones de carga en aisladores y conductores
- Trazado de rayos con espejos: imágenes reflejadas
- Aceleración: definición, ecuación y ejemplos
- Actividades y juegos del principio de Arquímedes
- ¿Qué es un terremoto? – Definición y componentes
- Corrosivo: Definición y ejemplos
- Ingeniería genética: lección para niños
